| Navigation |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
| |
Hier nun das Periodensystem der Elemente:
Ph (potentia Hydrogenii)-Wert Berechung:
pHp = -lg [LH2+]
2LH  LH2+ + L− (allg. Formulierung der Autoprotolyse) LH2+ + L− (allg. Formulierung der Autoprotolyse)
- LH2+ = Lyonium-Ion
- L− = Lyat-Ion
Durchschnittliche ph-Werte gebräuchlicher Lösungen:
| Substanz |
pH-Wert |
Art |
| Batteriesäure |
1,0 |
sauer |
| Magensäure (nüchterner Magen) |
1,0–1,5 |
| Zitronensaft |
2,4 |
| Cola |
2–3 |
| Fruchtsaft der Schattenmorelle |
2,7 |
| Essig |
2,9 |
| Orangen- und Apfelsaft |
3,5 |
| Wein |
4,0 |
| Saure Milch |
4,5 |
| Bier |
4,5–5,0 |
| Saurer Regen |
< 5,0 |
| Kaffee |
5,0 |
| Tee |
5,5 |
| Regen (natürlicher Niederschlag) |
5,6 |
| Mineralwasser |
6,0 |
| Milch |
6,5 |
| Wasser (je nach Härte) |
6,0–8,5 |
sauer bis basisch |
| Menschlicher Speichel |
6,5–7,4 |
| Blut |
7,4 |
basisch |
| Meerwasser |
7,5–8,4 |
| Pankreassaft (Darmsaft) |
8,3 |
| Seife |
9,0–10,0 |
| Haushalts-Ammoniak |
11,5 |
| Bleichmittel |
12,5 |
| Beton |
12,6 |
| Natronlauge (Ätznatron) |
13,5–15 |
Nernst-Gleichung:

Herleitung:

Massenwirkungsgesetz:
allgemein: 
vereinfacht: 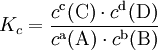 |
|
|
|
|
|
| |
Heute waren schon 1 Besucher (6 Hits) hier! |
|
|
|
|
|
|
|